医疗器械CE认证
-医疗器械CE认证(MDD认证-
MDD(93/42/EEC)认证指令是医疗器械CE认证出口欧盟国家必须办理的认证。所有医疗器械制造商或其授权的代表应确保将要进入欧洲经济区(EEA)的医疗器械必须满足该指令要求。
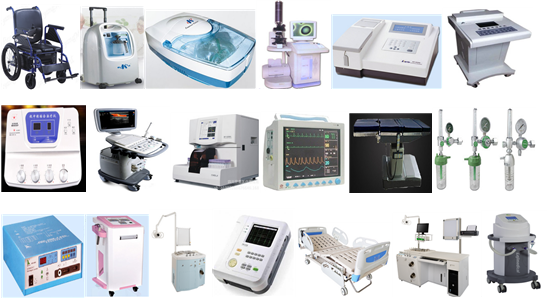
- 医疗器械CE认证-(MDD指令)适用范围 -

1.安全性(任何风险与器械提供的益处相比较,必须在可以接受的范围内,故亦称风险分析);
2.风险的可预防性或被消除性,至少应给予警告(报警系统或警戒报警系统);
3.性能符合性(产品的基本要求);
4.器械性能和安全的效期(器械的安全和性能必须在器械的使用寿命内得到保证。);
5.器械的储存和运输(应保证器械在合理的运输、储存条件下不受影响)。

二、基本要求的具体包括如下
1.器械设计和生产必须保证:按照其预定和条件使用,器械不会损害医疗环境、患者安全、操作者或其他人员的安全和健康;使用时的潜在危险与患者受益相比较可以为人们所接受,但应具有高水平的防护办法;
2.生产者的设计和制造方案,必须考虑在现有工艺技术条件下遵守安全准则,生产者应:
首先:应尽可能降低甚至避免危险;
其次:对无法避免的危险采取适当的防护措施,包括安装报警装置;
最后,告知用户所提供防护措施的弱点及其可能带来的危险。
3.器械必须取得生产者期望获得的功能;
4.在生产线者确定的器械使用寿命期内,在正常使用可能出现的压力,第1、2、3款所指的各项性能应保持稳定,不能危害医疗环境、危害患者、使用者或其他人员的健康;
5.器械的设计、生产和包装应当保证,器械的性能在运输和储存过程中只要遵守有关规定不会发生根本逆变;
6.副作用的大小同器械的使用性能相比较可以为人们所接受;
7.化学、物理和生物性能;
8.感染和微生物污染;
9.组装和环境因素;
10.检测器械;
11.辐射防护;
12.带有能源或与其他能源相连接的器械;
13.生产者提供的操作信息;
14.如果需要根据医疗数据确定器械是否满足基本要求,如第六款的情形,有关数据必须按照附录Ⅹ的规定取得
- 医疗器械CE认证-MDD认证分类 -
医疗设备分有不同的类别等级根据医疗设备指令指导性文件(MEDDEV 2.4)并且每个指令有一个规则(Rule),根据不同的要求共分为6个等级,供认证机构评估:
1) Class I other 1类其他
2) Class I sterile 1类灭菌
3) Class I measurement function 1类测量
4) Class IIa 2a类
5) Class IIb 2b类
6) Class III and Class III with medicine 3类及3类带药物

- 医疗器械CE认证-MDD认证技术文件 -
1. Information about manufacturer制造商信息(Name and address of manufacurer, Location and address of manufacture and design制造商名称地址,制造设计名称地址)
1.1 Decleration of Conformity自我宣告
1.2 European Representative 欧洲代表

埃可森企业管理咨询(广东)有限公司 版权所有 Copyright@2017 All Rights Reserved. 备案号:粤ICP备17098976号
18022213930
